近畿大学 理工学部 生命科学科 |Kindai University: Department of Life Science, Faculty of Science and Engineering
分子腫瘍学研究室について
2004年に開設された当研究室では、「がんの臨床」を常に念頭におきながら大学院生・学部生たちとともに学術論文を通して多くの研究成果を世界へ発表しています。
がん治療に向けた標的分子として「脂質メディエーター受容体シグナル」に着目し、
1)発がん過程への関与、
2)がん細胞の細胞機能の制御 に深くかかわることを明らかにしてきました。
さらに現在は、
3)“抗がん剤抵抗性”となったがん細胞に対する細胞内シグナルの生物学的役割
4)がん細胞の放射線抵抗性の獲得機構とその制御メカニズム の解明を行っています。
1)多段階発がんに関与する遺伝子異常
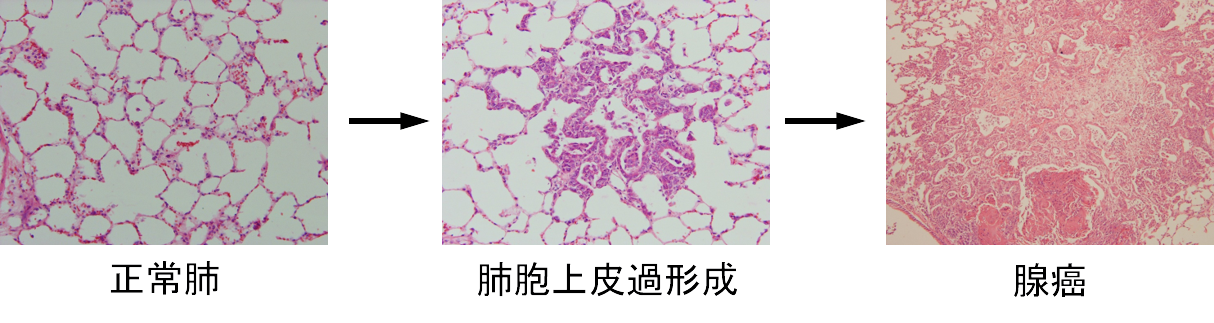
がんは、正常細胞が質的に複数の遺伝子変異を蓄積しながら異なる多段階のステップを経て発生します。私たちの研究室では、動物発がん実験モデルで誘発した肺・膵・肝がんを用いて、前がん病変からがん細胞への進展、さらに浸潤・転移に関与する遺伝子変異を見出してきました。
特に、リゾフォスファチジン酸(LPA)受容体遺伝子変異が高頻度に肺がん・肝がんで生じていることを世界に先駆けて報告しました。
また、大腸がんをはじめとするがん培養細胞において、
LPA受容体遺伝子発現喪失・低下がDNAプロモーター領域のメチル化異常によることを発見しました。
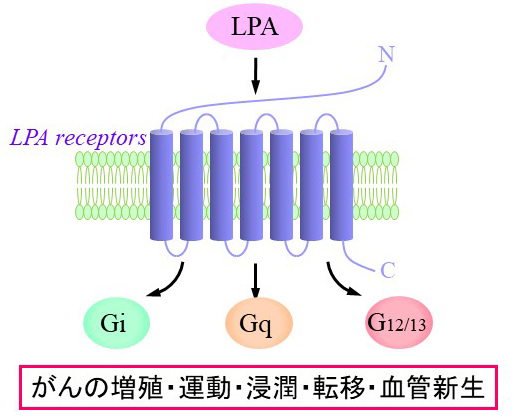
2)がん細胞の増悪化に関わる細胞内シグナルの分子機構
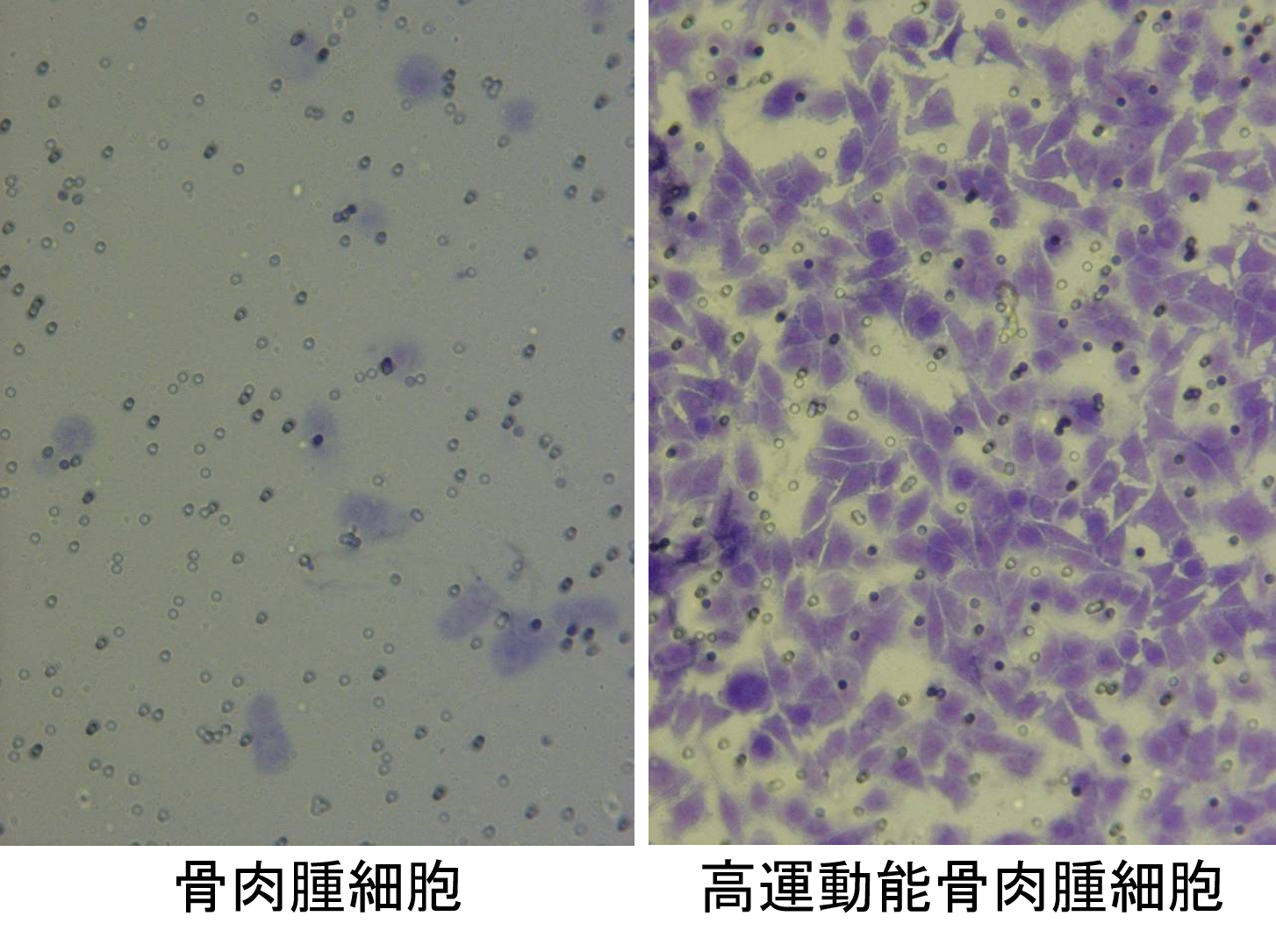
| がん細胞は発生した後に、増殖・浸潤・転移・血管新生さらには抗がん剤抵抗性など、時間の経過とともに増悪していきます。このようながん細胞の増悪化にともなう細胞機能を検索するために、私たちの研究室では元のがん細胞とは生物学的特性の異なる細胞を独自に樹立し解析を行っています。 ① 高運動能がん細胞(大腸がん・骨肉腫・肺がん細胞等) ② 高浸潤能がん細胞(膵がん細胞) ③ 抗がん剤抵抗性がん細胞(膵がん・肺がん・大腸がん・骨肉腫・メラノーマ細胞等) |
|
 |
 |
3)抗がん剤抵抗性獲得における細胞内シグナルの生物学的役割
私たちの研究室では、抗がん剤が効かなくなったがん症例の予後改善を念頭に、抗がん剤感受性制御におけるLPA受容体シグナルの関与を解析しています。現在までに、LPA受容体を介する細胞内シグナルが抗がん剤の作用を増強または減弱することを見出しています。
4)がん細胞の放射線抵抗性の獲得機構と制御メカニズム
放射線がん治療は外科手術と比較して局所療法であり、臓器や身体機能の温存ができるため、注目を集めています。その一方で、がん細胞では正常細胞に比べて、DNAの損傷形成や修復過程において異なる反応(亢進/抑制)を示すことで、二次がんの発生や転移など放射線による治療効果に影響を及ぼす可能性もあります。
放射線がん治療を推進するには、腫瘍と正常組織の複雑な応答メカニズムを把握することが不可欠ですが、未解明の部分が多いです。
私たちは、種々のがん培養細胞に対して放射線を照射し、「細胞増殖」や「DNA損傷・修復の可視化・定量」、「細胞の機能調節」を調べることで、
放射線感受性の変化や放射線抵抗性の獲得に関与する原因経路の解明し、より効果的な放射線がん治療の確立を目指しています。