OverView
おかあさんのお腹の中で、細胞分裂と分化を繰り返し、胎児は成長していきます。
「発生」と呼ばれるこの大切な時期は、様々な内的、外的要因に高感受性で、多大な影響を受けると奇形や先天異常を引き起こしてしまう可能性があります。
発生期から生後の発達期を含め、この時期の子供たちをとりまく環境は、発達期だけでなく成熟後の健康と生活を左右するほど重要な要因であることが分かってきました(Developmental
Origin Health and Disease: DOHaD仮説)。
つまり、妊娠、授乳中におかあさんたちが健康で幸せであることは、子供たちの健やかな成長にとっても大切なことだと言えます。
発生生物学研究室では、特に脳の発生と高次脳機能の発達に着目して、妊娠、授乳期の母胎環境が子どもの健康と成長に及ぼす影響を明らかにすることを目指しています。
大脳皮質の形態形成と発達
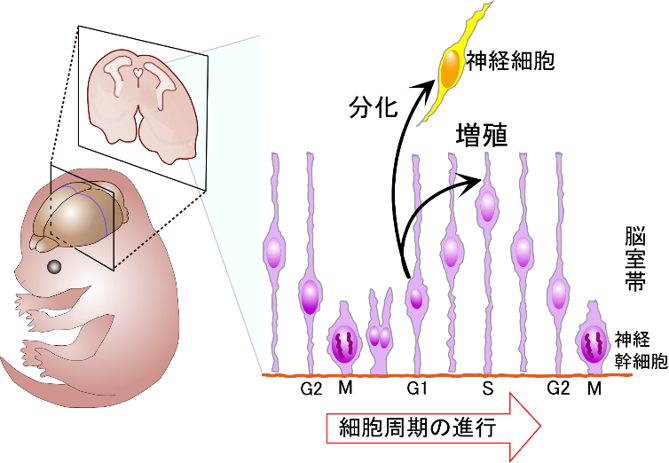
脳では、おなかの中にいるときにほとんどの神経細胞ができてしまい、生まれてから神経細胞同士をつなぐ神経ネットワークが構築されます。
大脳の表面に広がる灰白質である大脳皮質は、知覚、随意運動、思考、推理、記憶などの高次脳機能を支配する脳の領域です。同じ時期に生まれ、同じ特徴を持った神経細胞が層状に集まり、6層構造を持つ大脳皮質が形成されています。発生期において、時間情報が位置情報に置き換えられて、神経細胞の分布は厳密に制御されているのです。
どういうことでしょうか?
大脳皮質の原基は終脳の背側で、そこに局在する神経幹細胞である放射状グリアが対象分裂によって自己複製を、非対称分裂によって神経新生を繰り返して、大脳皮質の形態形成が行われています。それぞれの放射状グリアは分裂する回数と神経細胞を産生するタイミングが厳密に制御されているので、この時期に産まれた神経細胞は何層に局在するかを規定することができます。これによって、時間情報を位置情報に置き換えることができるのです。
最終分裂を終え、分化した未熟な神経細胞は、放射状グリアの突起を伝って脳表面へと移動し(トランスロケーション)、突起から離れて適切な場所へと移動します(ロコモーション)。この時に遅く生まれた細胞は上層に、早く生まれた細胞は下層に位置するインサイドアウトの様式で大脳皮質は形成されます。
大脳皮質は進化の過程において、インサイドアウトの様式を取ることでその形態を外側に向けて大きく展開することができたのです。
出生時には、胎児期に構築された神経細胞の分布を基に、生後神経ネットワークが形成されはじめます。神経細胞は脳の様々な領域に神経突起を伸ばして投射を行うことでシナプスを形成し、神経ネットワークを形成します。生後の発達期には、外的環境からの様々な刺激に応答します。その際に神経ネットワークの再構築が行われ、より環境に適した神経回路が構築されます。
このように、神経細胞が産生される時期、神経ネットワークが構築される時期の脳内は動的な環境にあり、内外の環境因子に対して高感受性であり、脆弱であるとも言えます。
そのため、様々な要因によって大脳皮質の組織構築や高次脳機能の発達に影響が引き起こされる可能性があります。
環境要因と脳の発達異常
では、大脳皮質の形態形成や発達に影響を及ぼす因子にはどんなものがあるのでしょうか。
発生生物学研究室では、特に環境要因に着目して妊娠、授乳中のおかあさんと子どもたちを取り巻く環境の重要性について研究を行っています。
例えば、妊娠中のストレス、薬物や化学物質の摂取、感染症への罹患など様々な要因が考えられます。
これらの因子が胎内で、細胞を傷害したり、遺伝子の発現を変化させたり、シグナル伝達に異常を引き起こしたりすることで、生理的な変化を誘発し、神経新生や細胞移動、神経投射に重篤な影響を引き起こす可能性があります。
その具体的な研究内容を次項から紹介していきます。
妊娠、授乳中のアルコール摂取が誘発する先天異常
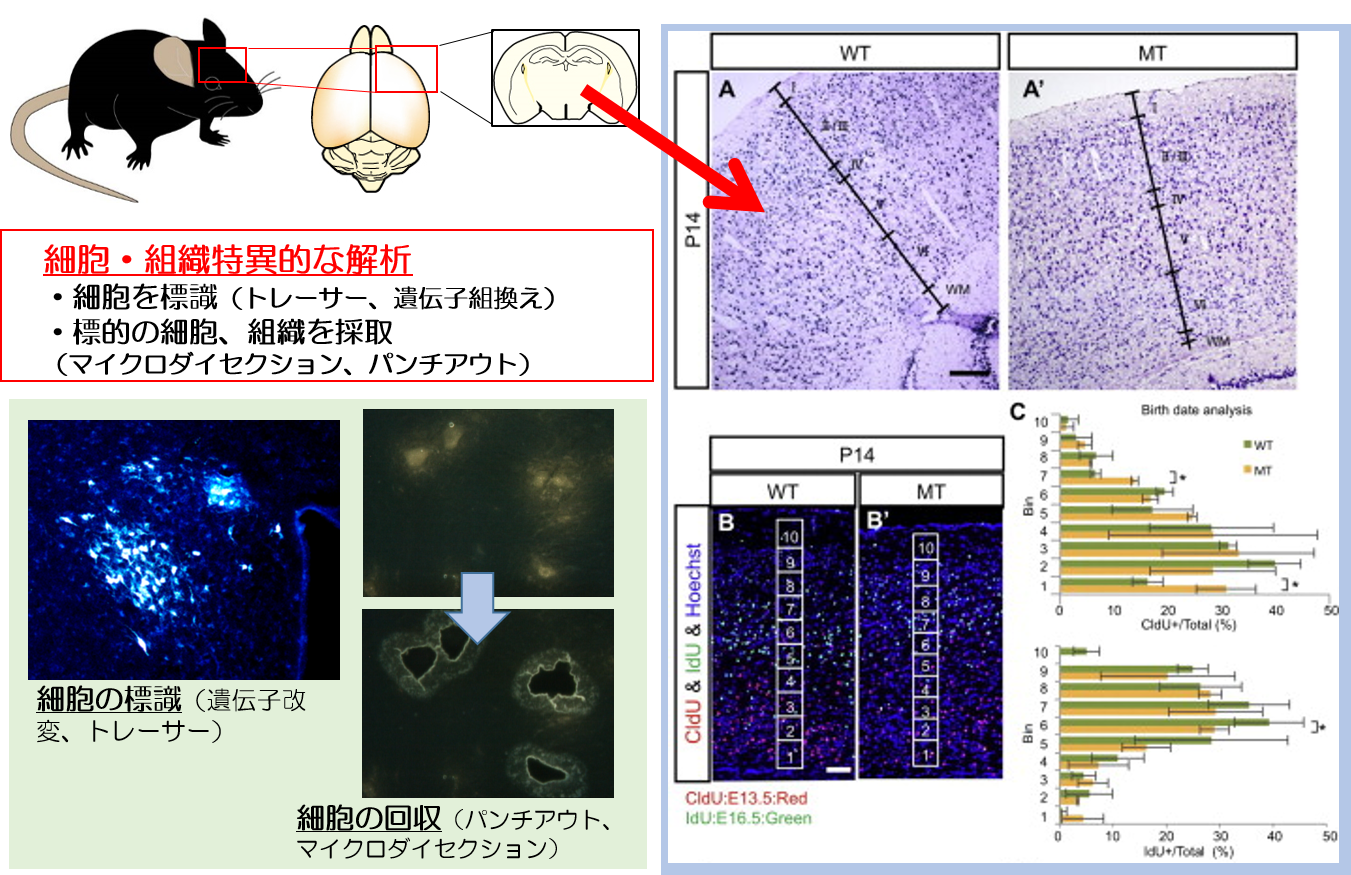
お酒のCMなどで「妊娠、授乳中の飲酒は控えてください」と書かれているのを見たことはないでしょうか。妊娠中にアルコールを摂取すると胎児アルコール症候群という先天異常を発症する可能性があります。特徴的な顔貌や、精神発達遅滞、学習障害などの先天異常、発達障害を引き起こす可能性が示唆されています。
アルコールの細胞毒性の作用や、それに伴う脳内炎症、さらにはエピジェネティクスな異常による遺伝子発現の攪乱などの要因によって、ミクログリアが異常に活性化し、神経新生や神経投射に異常が引き起こされていることを明らかにしました
脳内炎症とミクログリアを標的とした先天異常の新規予防法
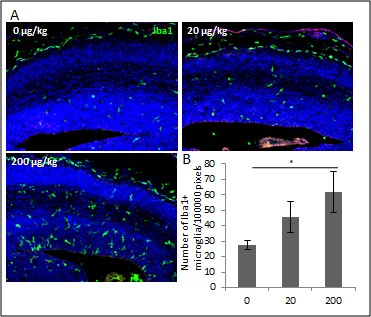
胎児や新生児においても、慢性的な脳内炎症が、細胞を傷害したりミクログリアを活性化したりすることによる発生、発達過程への影響が懸念されています。
脳内炎症というと、例えば感染症に罹患したりすることによって引き起こされますが、それ以外にも、エタノールや内分泌かく乱物質の曝露、ストレス曝露などにおいても幅広く誘発されている現象であることが分かってきました。
先天異常や発達異常は、ほとんどの場合に発症してしまうと根本的な治療をおこなうことが困難です。そのため、発症しないように予防することが非常に重要です。
エタノールの胎児期曝露によって誘導された形態学的異常や遺伝子発現の異常が、抗炎症作用を持つ薬剤の平行投与によって軽減できることが分かりました。同時にミクログリアの異常な活性化も抑制されていたことから、
●エタノールの胎児期曝露によって、脳内炎症とそれに伴うミクログリアの異常な活性化が誘導されていること
●これらの異常は、脳の形態異常の原因となっていること
●脳内炎症を抑制することで、様々な脳の異常を予防することが可能なこと
を示しています。
つまり、脳内炎症が胎児期の脳内で幅広く起こり、それが先天異常や発達障害の原因となっているとすれば、抗炎症作用を標的とした新規予防法を確立できる可能性があるのです。
妊娠中のストレスが脳機能の発達に及ぼす影響
妊娠、育児中のおかあさんは様々なストレスにさらされています。おかあさんにストレスがかかると、子供たちにも良くない影響が出そうですね。
妊娠中でも脳がストレスを感知すると、視床下部-下垂体後葉-副腎皮質、あるいは視床下部-下垂体前葉―副腎髄質の経路によって、コルチゾールやノルアドレナリンなどのストレス応答ホルモンが分泌されます。特にコルチゾールは、胎児の脳内に移行すると神経新生や細胞増殖を阻害することが分かっています。
いつ頃の、どのようなストレスが、子どもたちにどんな影響をするのかを明らかにすることで、妊娠、授乳中のおかあさんたちをストレスから、社会全体で守っていくように提言することができます。
しかし、完全にストレスを0にすることは難しいでしょう。
ストレスの曝露によって脳内炎症が誘発されていることを、これまでの研究で明らかにしています。だとすれば、ストレス曝露による先天異常や発達障害の誘発も、抗炎症剤によって予防できる可能性を模索しています。
催奇形性のある薬剤が発達障害を誘発するメカニズム
疾病の治療に用いられる薬剤には、優れた薬理作用以外に副作用が引き起こされることがあります。
特に、おかあさんが妊娠、授乳期には服用する場合には、子どもに先天異常を誘発する催奇形性という副作用が懸念されるため、医師の診断、用法、用量をしっかりと守らなくてはいけません。
胎児期、新生児期の子どもたちは、細胞が非常に動的な状態にあるため、薬物の作用に対して高感受性であり、脆弱です。また、代謝、排泄機構機構が不十分なため、体内に留まりやすいということも懸念されます。
バルプロ酸という優れた抗てんかん薬がありますが、催奇形性があるため妊娠中の服用は禁忌とされています。
しかし、神経の異常な興奮が脳全体に伝播することによる不随意な発作を繰り返すてんかんは、その発作の発火自体が母体も胎児も危険にさらすため、抗てんかん薬を用いた発作のコントロールが必須です。
妊娠期間中は他の薬に替えて発作をコントロールすることが望まれますが、うまくいかない場合には困ってしまいますね。しかし、バルプロ酸の催奇形性の臨界期などの閾値、さらにはその作用機序が分かっていれば、薬を服用する時期や容量について、より検討することもできるかもしれません。
現在、バルプロ酸の胎児期曝露による脳の形態形成や高次脳機能の発達に及ぼす影響を、分子生物学、形態学的に解析しています。
さらに、バルプロ酸には自閉症の発症リスクを上昇させること、バルプロ酸の胎児期曝露モデルマウスが、自閉症様の行動異常を示すことから、自閉症との関連についても懸念されています。
高次脳機能の発達を行動実験によって捉える
自閉症や注意欠損多動性症候群(ADHD)などの発達障害は、先天的な脳の機能異常が原因であると考えられています。つまり、胎児期の遺伝子の発現異常などの内的要因と、環境要因などの外的要因によって、目に見えないような小さな傷ができ、それが機能異常に関係している可能性があります。
バルプロ酸以外にもストレス曝露や感染症の罹患など、様々な要因によって発達障害の発症リスクが上昇することが懸念されているため、その発症メカニズムを明らかにすることは急務です。
発達障害の主な症状の一つに社会的相互作用の異常があります。他人との接し方、距離感をうまくつかめないなどのコミュニケーションの質的異常です。
発達障害モデルマウスを用いて、特に社会的相互作用を標的とした様々な行動解析を行っています。特に、ヒトもマウスも集団で生活する動物であることから、複数個体を同時にモニタリングできる新規解析システムを用いて、社会的相互作用の異常の遠因となる脳の構造異常を明らかにすることを目指しています。
主な年間行事(令和3~4年度)
| 日時 | 内容 | 場所 |
|---|---|---|
| 2月24日 | 令和3年度卒業論文公聴会 | 東大阪キャンパス (@オンライン) |
| 3月19日 | 令和3年度卒業証書授与式 | 東大阪キャンパス |
| 3月27~29日 | 日本解剖学会学術集会 | 大阪(@大阪大学/ハイブリット) |
| 4月2日 | 令和4年度入学式 | 校庭 |
| 7月 | 日本先天異常学会学術集会 | 金沢(ハイブリット) |
| 毎月1回 | プログレスミーティング ※研究の進捗状況を発表してもらいます |
研究室 |